活细胞的高通量筛选对于有效药物的发现、理解细胞进程的研究、以及推进个性化药物的安全检测至关重要。目前,大多数基于细胞的高通量筛选是基于多孔板培养,并辅以复杂的移液步骤实现药物的添加。然而,这种操作步骤繁琐,特别是针对较小液滴内培养的非贴壁细胞,对培养液的频繁扰动会干扰细胞的行为,影响实验的准确性。如何实现在不同时间点向数千个液滴平行进行程序性的药物添加,并同时确保最小的机械干扰,是细胞高通量筛选领域中的一项挑战。
近日,冯文骞研究员团队提出利用光触发药物递送系统远程控制药物从固体表面释放,从而以无机械干扰的形式将特定的药物分子添加于细胞培养环境。利用偶氮苯衍生物表现出的顺反光异构性,加上超分子非共价相互作用的动力学性质,实现在微图案化的聚合物芯片上进行细胞高通量筛选中药物的可编程添加。该芯片不仅准确控制药物装载量、调节药物的装载种类,也克服了装载和释放过程中的交叉污染,并利用DMD光源的投影特性实现了对大量液滴单元进行独立且程序化的进程管理。相关工作“Compact Micropatterned Chip Empowers Undisturbed and Programmable Drug Addition in High-Throughput Cell Screening”为题发表在Advanced Materials期刊上,论文的第一作者为硕士研究生赵元轶,通讯作者为冯文骞研究员。

首先,甲基丙烯酸2-(2-溴异丁酰氧基)乙酯(BrMA)被用作疏水活性单体,通过光引发的相分离聚合方法在玻璃基底上一步制备具有原子转移自由基聚合(ATRP)活性的多孔超疏水聚合物薄膜。薄膜的多孔结构为超疏水/亲水性能提供必要的表面粗糙度、有效的药物负载面积、以及药物释放所需的传质通道。随后,2-(全氟辛基)乙基甲基丙烯酸酯通过ATRP反应在薄膜上聚合,构建超疏水、高疏油氟化边框。在氟化边框内部,4-(甲基丙烯酰氨基)偶氮苯(Azo-MA)分子进行聚合度可控的接枝,并与α-环糊精(α-CD)药物水溶液进行组装,在氟化边框内部形成亲水的药物负载区域。
当细胞培养液滴与该芯片接触时,它仅渗透到亲水载药区域,形成与(一个或多个)载药区域连接的细胞培养库。利用DMD光源对该独立细胞培养库内载药区域进行程序化曝光,诱导曝光区域内的Azo-MA分子发生构型转换和组装体解离,促使α-CD药物分子从薄膜内部向细胞培养液滴中扩散,从而实现无机械干扰的精确药物递送。数字光处理(DLP)设备的宽投影范围允许在大量液滴中平行添加药物,同时确保每个液滴都有自己独立的曝光程序,为细胞的高通量平行筛选中无机械干扰、可编程的药物添加提供了保障。
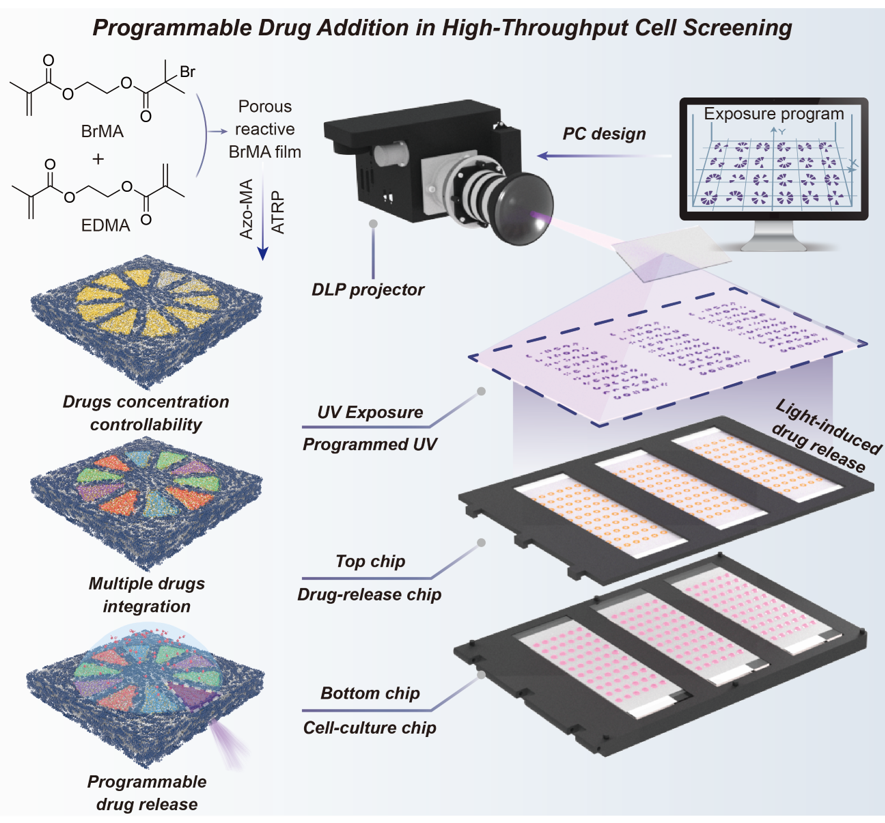
图1.图案化BrMA-Azo薄膜用于高通量细胞筛选的示意图,通过光诱导实现单个微液滴内无机械干扰、程序性的药物添加
构筑的Azo-MA接枝薄膜表现出类似于偶氮苯单体的光异构化转变,并且接枝前后薄膜的多孔结构没有改变。在紫外曝光区域,薄膜上的α-CD分子在120秒内完全解离。
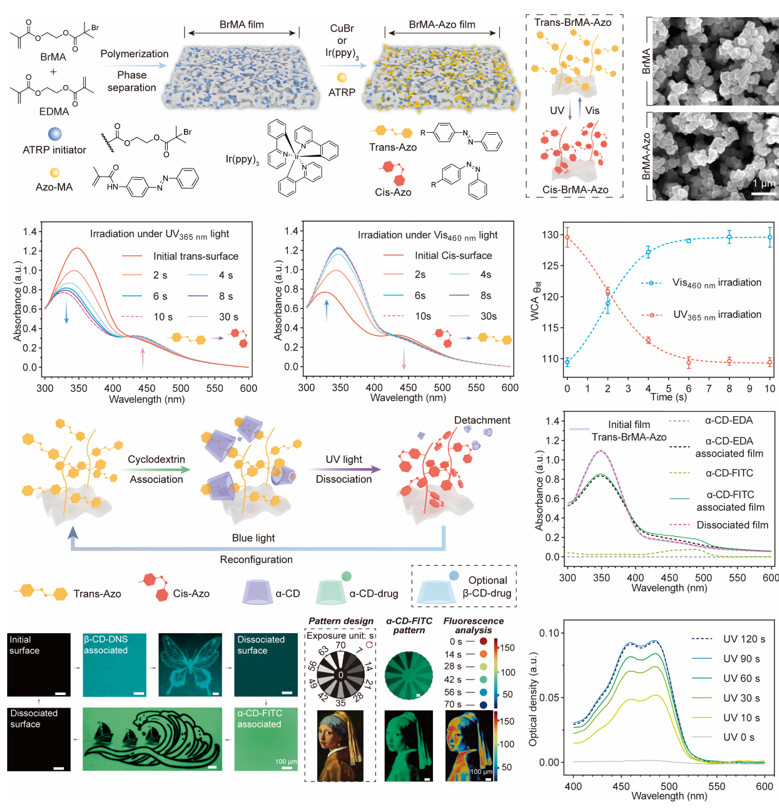
图2.偶氮苯单体接枝多孔聚合物膜的光异构化和光调控的曝光区域内的药物释放
当细胞培养液滴与该芯片接触时,它仅渗透到亲水载药区域,形成与载药区域连接的细胞培养库。由于反式Azo-MA⊂α-CD复合物在可见光或黑暗(组装状态)的水性环境中的稳定性质,芯片有效地将薄膜负载的药物保持在组装状态而不发生泄漏。无论微液滴悬挂或夹在药物释放芯片下方,特异性的光诱导药物释放至细胞培养液滴中都是可行的,从而实现细胞在悬浮培养或贴壁培养中的无扰动药物添加。
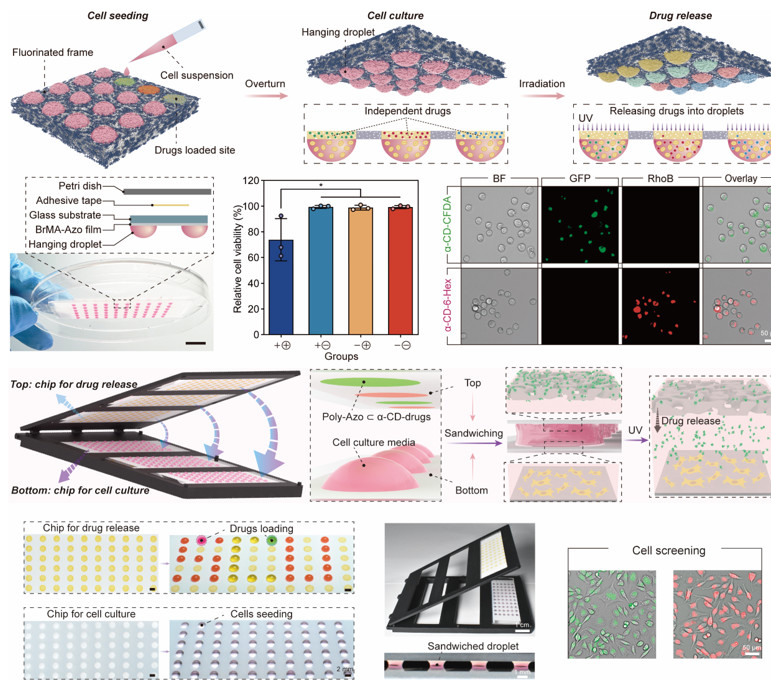
图3.悬挂培养液滴和夹层培养液滴中光诱导的药物添加
利用光刻法在设计药物释放芯片的图案形状时,通过超疏水边界将Azo-MA接枝的圆形区域划分为独立的扇区,每个扇区装载特定的药物。通过把大小相同的圆形液滴夹在药物释放芯片下方,液体同时渗透到多个载药区,形成与多个载药区域相连的细胞培养库。利用DMD光源对特定的载药区域进行曝光,可以在液滴内精确和程序化地释放药物。

图4.在条件紫外光照下将多种药物程序化添加到细胞培养液滴中
原文链接:https://onlinelibrary.wiley.com/doi/10.1002/adma.202306814
撰稿:赵元轶
编辑:杨燕玲
审核:刘向阳